初回で受理されるヒューマンファクター関連の提出はわずか4~11%
FDAが2019年に提出された申請を分析したところ、FDAに提出された228件の510(k)の申請のうち、初回の提出時にHF審査の準備ができていると見なされたのは、わずか11件だけでした。FDAの分析によると、合計で542件のHFE申請のうち、FDAが初回の審査の準備ができていると見なしたのは、わずか23件、即ち4%だったとのことです。
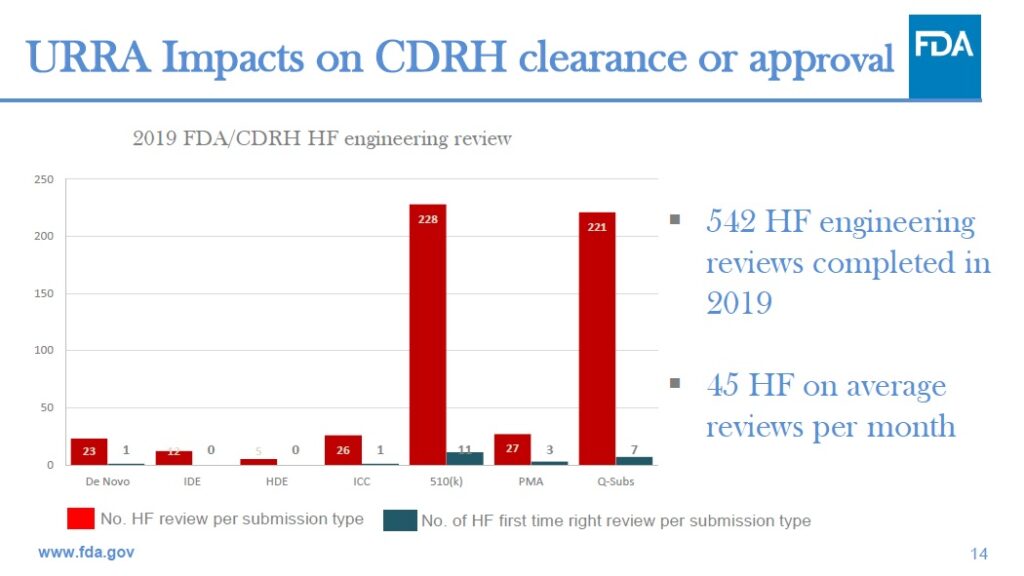
使用関連リスク分析 (Use-Related Risk Analysis)が最も重要
FDAの分析によると、使用関連リスク分析 (Use-related risk analysis; URRA)の問題はHFE提出書類の不備の80%に寄与したという結果がでています。指摘された不備には、URRAを提供していないことや、不適切なURRAプロセスを用いていること、クリティカルタスクの選定が不適切であることなどが含まれますが、これらに限りません。
FDAは、HFEガイダンスの中で、URRAがHFE申請に関連する焦点であり、優先事項であることを明確にしています。FDAガイダンスでは、 “ユーザーが誤ってタスクを実行したり、タスクを実行しなかったりすることが重大な危害をもたらす可能性があることを示す機器については、製造業者は市販前申請においてHuman Factors関連データを提出すべきである” と述べられています。
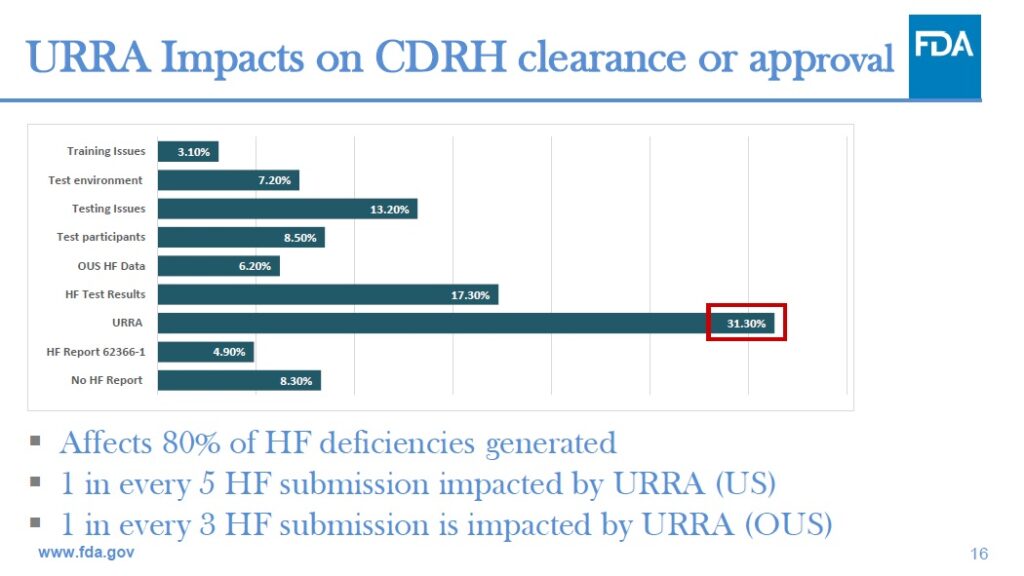
そして、アメリカ国内 (US)からの提出とアメリカ国外 (OUS)からの提出ではその割合も違いがあると書かれています。如何に米国の厳しい規制について行けていないのかが分かるのではないかと思います。
FDAが指摘するヒューマンファクター関連の不備は多岐にわたる
そしてもちろんFDAが指摘する事項はURRA関連の不備だけではありません。Human Factors試験 (一般的に模擬使用ユーザビリティ試験)の設計や実施方法に関する不備であったり、結果の分析方法であったり、その他ドキュメント類の内容であったり、製品によっては非常に厳しく確認されることもあります。
FDAには、Human Factors専門の審査官がおり、Human Factors関連データは主に彼らが確認することになります。そのような専門性をもった審査官が確認しているということが、他国の当局や第三者認証機関とは大きく異なるところかもしれません。
FDAや専門家と早い段階から連携することが重要
もちろんHuman Factors関連データは、FDAに対して提出される申請書類の中の一部分のデータでしかありません。でもFDAではこのように医療機器のヒューマンファクターエンジニアリングも重要であると位置づけ、厳しく確認されているということが分かるのではないかと思います。だからこそ、FDAはまた同時にPre-submissionsなどを通して、早い段階からFDAにHuman Factors関連の相談をすることやHuman Factors試験のプロトコルを事前に提出することなどを推奨しています。そして、だからこそ外部の専門家や協力会社も存在するのだと思います。
単に規制ができても、それを正しく理解し要求する当局や認証機関がいなければ、何も始まりません。他国では如何に厳しく確認されようとも、別の国々ではよく分かっていない人々が確認をしている、指定の文書が揃っているかくらいしか見ていない、それでは成り立ちません。そのような後者の国々はますます遅れをとり、議論にもついて行けなくなるでしょう。日本や中国ではこの規制ができたばかりです。今後の動向に期待したいと思います。
参考文献:
Bailey, R. (2023, November 10). Risk Adverse: Avoiding deficiencies in submissions. Med-Tech Innovation. https://www.med-technews.com/medtech-insights/medtech-regulatory-insights/risk-adverse-avoiding-deficiencies-in-submissions/
U.S. FDA. (2016, February). Applying Human Factors and Usability Engineering to Medical Devices: Guidance for Industry and Food and Drug Administration Staff. Retrieved from https://www.fda.gov/regulatory-information/search-fda-guidance-documents/applying-human-factors-and-usability-engineering-medical-devices.
Wiyor, H.D. (October 22, 2020). Risk Assessment of Medical Products in Human Factors Submissions with a Focus on EU countries. MHFN Webinar. https://medicalhumanfactorsnetwork.com/wp-content/uploads/2023/04/Risk-Assessment-of-Medical-Products-in-Human-Factors-Submissions-with-a-focus-on-EU-Countries-20OCT2020-1.pdf



